Geometria linear:
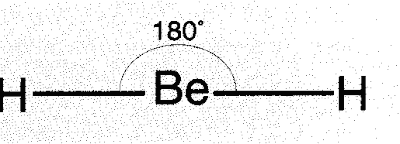 |
| Fig.1- Exemplo da geometria linear |
Molécula polar e apolar:
Como saber se as moléculas diatómicas são polares ou apolares - quando estamos na presença de átomos com moléculas muito diferentes são moléculas polares, e quando estamos na presença de átomos com moleculas iguais são moléculas apolares.
Molécula apolar (não tem polos): átomos iguais
Molécula polar (tem polos): átomos muito diferentes
Liquido polar (com moléculas polares) mistura-se com liquido polar
Liquido apolar (com moléculas apolares) mistura-se com liquido apolar
 |
| Fig.2 - Molécula apolar |
 |
| Fig.3- Molécula polar |









